- English
- Español
- Português
- русский
- Français
- 日本語
- Deutsch
- tiếng Việt
- Italiano
- Nederlands
- ภาษาไทย
- Polski
- 한국어
- Svenska
- magyar
- Malay
- বাংলা ভাষার
- Dansk
- Suomi
- हिन्दी
- Pilipino
- Türkçe
- Gaeilge
- العربية
- Indonesia
- Norsk
- تمل
- český
- ελληνικά
- український
- Javanese
- فارسی
- தமிழ்
- తెలుగు
- नेपाली
- Burmese
- български
- ລາວ
- Latine
- Қазақша
- Euskal
- Azərbaycan
- Slovenský jazyk
- Македонски
- Lietuvos
- Eesti Keel
- Română
- Slovenski
- मराठी
- Srpski језик
SARS-CoV-2抗原検出キット(ラテックスイムノクロマトグラフィー)
SARS-CoV-2 抗原検出キット (ラテックス イムノクロマトグラフィー) は、SARS-CoV-2 鼻腔内ぬぐい液、咽頭ぬぐい液、喀痰、気管支肺胞、洗浄液からの核タンパク質の定性的検出を目的としたラテラル フロー イムノアッセイです。
お問い合わせを送信
SARS-CoV-2抗原検出キット(ラテックスイムノクロマトグラフィー)
使用説明書
SARS-CoV-2 抗原検出キット(ラテックスイムノクロマトグラフィー)は、SARS-CoV-2 鼻腔内ぬぐい液、咽頭ぬぐい液、喀痰、気管支肺胞、洗浄液からの核タンパク質の定性的検出を目的としたラテラルフローイムノアッセイです。これは専門家によって検査として使用され、新型コロナウイルス感染症 (COVID-19) の疑いのある人の感染の診断に役立つ予備的な検査結果が得られます。
この検査は臨床検査機関または医療従事者がポイント・オブ・ケア検査で使用する目的でのみ提供されており、家庭での検査では提供されません。
抗原検査の結果は、SARS-CoV-2 感染を診断または除外したり、感染状況を知らせたりするための唯一の根拠として使用されるべきではありません。診断は、臨床症状または他の従来の検査方法と組み合わせて確認する必要があります。
試験の概要と説明
新型コロナウイルスはβ属に属し、新型コロナウイルス感染症(COVID-19)は急性呼吸器感染症です。人々は一般的に影響を受けやすいものです。現在、新型コロナウイルスの感染者が主な感染源となっており、無症状の感染者も感染源となる可能性があります。現在の疫学調査によると、潜伏期間は1~14日、多くは3~7日となっています。主な症状は、発熱、倦怠感、空咳などで、まれに鼻づまり、鼻水、喉の痛み、筋肉痛、下痢が見られます。
抗原検出は、新型コロナウイルスの感染を診断するための一般的な方法です。この検査は、ラテックスイムノクロマトグラフィーアッセイに基づく SARS-CoV-2 核タンパク質抗原の検出に使用される免疫学的診断検査です。この方法は迅速かつ使いやすく、必要な機器もほとんどありません。最小限の熟練者であれば 15 ~ 20 分以内に実行できます。
テスト原理
このキットはラテックスイムノクロマトグラフィーアッセイを採用しています。
テストカードには次の内容が含まれます。
1. ラテックスミクロスフェアで標識されたマウス核タンパク質モノクローナル抗体および品質管理抗体複合体。
2. テストライン(T ライン)と 1 つの品質管理ライン(C ライン)を固定化したニトロセルロース膜。
適切な量のサンプルがテストカードのサンプルウェルに追加されると、サンプルは毛細管現象によりテストカードに沿って前方に移動します。
サンプルに SARS-CoV-2 の抗原が含まれている場合、その抗原はラテックス ミクロスフェアで標識された SARS-CoV-2 抗体に結合し、ニトロセルロース膜に固定化されたモノクローナル抗ヒト抗体によって免疫複合体が捕捉され、免疫複合体が形成されます。赤い線 は、サンプルが抗原に対して陽性であることを示します。
検査試薬
各媒体の公称式は次のとおりです。
| 希釈剤 | テストカード |
| 水 90%-99% 塩化ナトリウム 0.1%-1% クエン酸ナトリウム 0.1%-0.5% Tween-20 0.1%-1% スクロース 0.1%-1% トレハロース 0.1%-1% プロクリン-300 0.01%-1% PEG20000 0.01 %-1%リン酸二ナトリウム 0.0001-1%リン酸二水素ナトリウム 0.0001-1% | BoraxMESNHSEDCマウスアンチ |
提供される試薬と材料
提供される資料:
| コンポーネント名 | 1T/箱 | 20T/箱 | 25T/箱 | 50T/箱 | 100T/箱 |
| 使い捨てテストカード | 1 | 20 | 25 | 50 | 100 |
| 乾燥剤 | 1 | 20 | 25 | 50 | 100 |
| 綿棒 | 1 | 20 | 25 | 50 | 100 |
| サンプル希釈液 | 500μl/チューブ×1 | 12ml/本×1 | 15ml/本×1 | 15ml/本×2 | 15ml/本×4 |
| 使い捨てプラスチックスポイト | 1 | 20 | 25 | 50 | 100 |
| チューブ | 1 | 20 | 25 | 50 | 100 |
または
| コンポーネント名 | 1T/箱 | 20T/箱 | 25T/箱 | 50T/箱 | 100T/箱 |
| 使い捨てテストカード | 1 | 20 | 25 | 50 | 100 |
| 乾燥剤 | 1 | 20 | 25 | 50 | 100 |
| 綿棒 | 1 | 20 | 25 | 50 | 100 |
| サンプル希釈液 | 500μl/チューブ×1 | 12ml/本×1 | 15ml/本×1 | 15ml/本×2 | 15ml/本×4 |
| ドロップボトル | 1 | 20 | 25 | 50 | 100 |
または
| コンポーネント名 | 1T/箱 | 20T/箱 | 25T/箱 | 50T/箱 | 100T/箱 |
| 使い捨てテストカード | 1 | 20 | 25 | 50 | 100 |
| 乾燥剤 | 1 | 20 | 25 | 50 | 100 |
| 使い捨てデバイス | 1 | 20 | 25 | 50 | 100 |
| バイオセーフティバッグ | 1 | 20 | 25 | 50 | 100 |
注: 1 つの使い捨てデバイスには、1 本の綿棒と 0.5 ml のサンプル希釈液が含まれています。
仕様:1T/箱、20T/箱、25T/箱、50T/箱、100T/箱
必要な資料が提供されていない
1.手袋、マスク、白衣、保護眼鏡などのPPE
2.バイオハザード廃棄物容器
3.チューブホルダー
警告と予防措置
1. 緊急時および指定された医療施設での医療または保健専門家による使用のみ。
2. テストを実施する前に、添付文書をすべてお読みください。添付文書の指示に従わないと、無効な検査結果が得られる可能性があります。
3. 標本を取り扱い、処理するときは、適切な保護服を着用してください。検体を扱った後は手をよく洗ってください。
4. 標準化された手順および米国 CDC の普遍的予防措置に従って、感染性病原体が含まれているかのように検体を取り扱います。
5.チューブやパウチに傷や破損がある場合は使用しないでください。
6. テストは単回使用のみを目的としています。いかなる場合でも再使用しないでください。
7. 湿度と温度は結果に悪影響を与える可能性があります。
8. 製品ラベルに記載されている保管上の推奨事項に従ってください。これらの条件外で保管および取り扱いすると、製品に悪影響を与える可能性があります。
9. 表示された使用期限を過ぎた製品は使用しないでください。
10. すべてのサンプルと使用済みのテストコンポーネントは、適切に承認され、ラベルが貼られたバイオハザード廃棄物容器に廃棄してください。
賞味期限と保管方法
1. 元の梱包は 2 ~ 30°C の乾燥した場所に、光を避けて保管してください。
2. 検査キットの有効期限は製造日から 1 年です。記載されている有効期限については製品ラベルをご確認ください。
3.内袋開封後、テストカードは吸湿により無効になりますので、1時間以内にご使用ください。
4. 元の梱包は 2 ~ 37℃で 20 日間輸送してください。
検体の収集と取り扱い
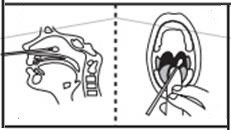
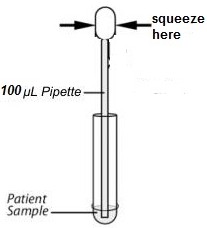
この検査は、人体の鼻腔スワブ、咽頭スワブ、喀痰、気管支肺胞、洗浄液、体液などを使用して実行できます。サンプルは検査に付属のコンポーネントを使用して収集できるため、すぐに検査する必要があります。テスト手順セクションの図を参照してください。
試験手順
1. 梱包箱を開け、内袋を取り出し、室温に戻します。
2. テストカードを密封袋から取り出し、開封後 1 時間以内に使用してください。
3. テストカードを清潔で水平な面に置きます。
|
|
|
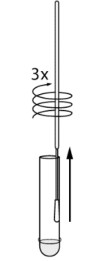
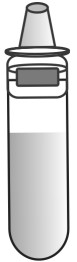
| ①SARS-CoV-2 鼻腔ぬぐい液、咽頭ぬぐい液、喀痰、気管支肺胞、洗浄液からの検体。 | ②サンプル希釈液をドロップボトルからチューブに500μl(約9~10滴)滴下します。患者綿棒サンプルをチューブに入れます。ヘッドをチューブの底部と側面に押し付けながら、スワブを少なくとも 3 回回転させます。 | ③スワブヘッドをチューブの内側に転がしながら取り外します。使用済みの綿棒はバイオハザード廃棄物として廃棄してください。 |
|
|

|
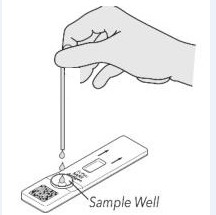
| ④付属の小型透明使い捨てプラスチックスポイトにチューブから採取した患者サンプルを入れるか、スポイトボトルに蓋をします。 | ⑤サンプル60~100μl(2~3滴)をテストカードに滴下します。 注意:サンプルをチューブから注がないでください。 | ⑥15分後に結果を読み取ります。結果は15〜20分以内に有効です。それは繰り返さなければなりません |
または

|
|
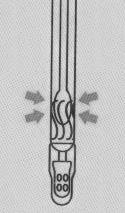
|
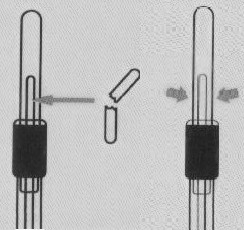
| ①SARS-CoV-2の鼻腔ぬぐい液、咽頭ぬぐい液、喀痰、気管支肺胞、洗浄液、体液からの検体。 | ②内側のセーフティコアを破り、液体をチューブの底に押し込みます。 | ③綿棒の先端を絞って検体を希釈します。 |
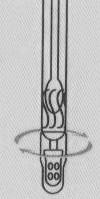
|
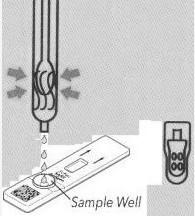
|

|
| ④テールキャップカバードリッパーをひねる | ⑤検体希釈液を約60~100μl(2~3滴)試薬カードに絞ります。 | 15 分で結果を読み取ります。結果は 15 ~ 20 分以内に有効になります。それは繰り返さなければなりません |
品質管理
1. テスト カードには内部手順制御が含まれています。このコントロールにより、十分な検体量と技術が適用されていることを確認できます。
2. このキットには制御標準は付属しません。
3. 適切な試験性能を検証するために、陽性対照と陰性対照の追加など、適切な検査室の慣行に従うことをお勧めします。
分析結果の解釈
1. 否定的:
品質管理ライン C のみが表示され、テスト ライン T が赤色でない場合は、抗原が検出されず、結果は陰性であることを示します。検出感度には限界があるため、製品の分析感度より低い抗原濃度では陰性結果が生じる可能性があります。
2. ポジティブ:
品質管理ライン C と検査ライン T の両方が表示された場合は、抗原が検出されたことを示します。陽性結果のサンプルは、診断を行う前に代替検査方法と臨床所見で確認する必要があります。
3. 無効:
精度管理ラインCが表示されていない場合は、赤色のテストラインの有無に関わらず検査結果は無効となるため、再度検査を行う必要があります。
結果が明確でない場合は、残りのサンプルまたは新しいサンプルを使用してテストを繰り返します。
テストを繰り返しても結果が得られなかった場合は、キットの使用を中止し、製造元に問い合わせてください。
性能特性
交差反応性
SARS-CoV-2抗原検出キット(ラテックスイムノクロマトグラフィー)は、インフルエンザA型H1N1抗原、インフルエンザA型H3N2抗原、インフルエンザB型抗原、アデノウイルス抗原、マイコプラズマ抗原、呼吸器合胞体抗原、黄色ブドウ球菌抗原、肺炎球菌抗原陽性検体について検査済みです。結果は、交差反応性を示さなかった。
干渉
臨床的に陰性のサンプルに一定濃度の病原体を添加しても、検査結果には干渉反応が生じません。追加された病原体を次の表に示します。
| 病原体 | 集中 | 病原体 | 集中 |
| ヒトコロナウイルス 229E | 1.0×10 6 pfu / ml | RSウイルス | 1.0×10 6 pfu / ml |
| ヒトコロナウイルスOC43 | 1.0×10 6 pfu / ml | アデノウイルス | 1.0×10 6 pfu / ml |
| ヒトコロナウイルスNL63 | 1.0×10 6 pfu / ml | インフルエンザ A H1N1 | 1.0×10 6 pfu / ml |
| コロナウイルスMERS | 1.0×10 6 pfu / ml | インフルエンザB型 | 1.0×10 6 pfu / ml |
テストの制限
1. この製品は、SARS-CoV-2 抗原の定性評価のみを目的としています。
2. この検査は、臨床検査機関または医療従事者によるポイント・オブ・ケア検査の使用のみを目的として提供されており、家庭での検査には提供されません。
3. 抗原検査の結果は、SARS-CoV-2 感染を診断または除外したり、感染状況を知らせたりするための唯一の根拠として使用されるべきではありません。診断は、臨床症状または他の従来の検査方法と組み合わせて確認する必要があります。
4. 陰性の結果は、特にウイルスと接触したことのある人の場合、SARS-CoV-2 感染を除外するものではありません。これらの個人の感染を除外するには、分子診断による追跡検査を検討する必要があります。
5. 検体中に存在する SARS-CoV-2 ウイルスの抗原の量がアッセイの検出限界を下回る場合、陰性または非反応性の結果が生じる可能性があります。
6.この検査では、ウイルスが生存しているかどうかに関係なく、SARS-CoV と SARS-CoV-2 を検出できます。検査の性能はサンプル中のウイルス(抗原)の量に依存しますが、検体中のSARS-CoV-2抗原力価と必ずしも相関するわけではありません。
7.抗原のレベルが検出限界を下回っている場合、またはサンプルが不適切に収集または輸送された場合、検査結果が陰性になる可能性があります。
8. テスト手順に従わない場合、テストのパフォーマンスに悪影響を及ぼしたり、テスト結果が無効になったりする可能性があります。
参考文献
1. チャオリン・ファン、イェミン・ワン、他中国武漢における2019年の新型コロナウイルスに感染した患者の臨床的特徴。ランセット.2020;VOL395:497-506。
2. Zhu N、Zhang D、Wang W、Li X、Yang B、Song J、他。中国の肺炎患者からの新型コロナウイルス、2019年。2020年1月24日。ニューイングランド・ジャーナル・オブ・メディシン。
3. ラマール A、タルボット PJ。ヒトコロナウイルス229Eの感染力に対するpHと温度の影響。カナダ微生物学ジャーナル。 1989;35(10):972-4。
4. ワン C、ホービー PW、ヘイデン FG、ガオ GF。世界的な健康上の懸念を引き起こす新型コロナウイルスの発生。ランセット。 2020年1月24日。